Чистка от ржавчины электролизом
Плюсы, недочеты и пошаговая {инструкция} по удалению ржавчины электролизом
 Совладать с ржавчиной и не разрушить железную поверхность – задачка сложная.
Совладать с ржавчиной и не разрушить железную поверхность – задачка сложная.
Механический метод ее удаления приводит к возникновению на изделии царапин, а хим реагенты провоцируют окислительные процессы, в итоге которых деталь в дальнейшем заржавеет еще посильнее.
Неопасным и относительно обычным методом борьбы со ржавчиной является удаление ее электролизом. О том, как эффективен этот способ и как его верно воплотить на практике, читайте в статье.
Эффективен ли метод?
Электролиз вправду помогает совладать с ржавчиной. Она представляет собой смесь окислов и гидроокислов железа, которые образуются при контакте сплава с водой и кислородом.
Если не углубляться в сложные хим процессы, то можно сказать, что способ дозволяет инвертировать окислительную реакцию назад и вернуть ранее покоробленные участки.
Плюсы и минусы чистки
 Электролиз, как способ борьбы с ржавчиной, полностью неопасен. Раствор электролитов не ядовит, но вовнутрь его употреблять не следует.
Электролиз, как способ борьбы с ржавчиной, полностью неопасен. Раствор электролитов не ядовит, но вовнутрь его употреблять не следует.
Выделяющиеся газы не токсичны, не способны к воспламенению. Токи употребляются маленькой частоты, потому нанести вреда здоровью они не сумеют.
Очередное преимущество способа – это отсутствие риска разрушить деталь. Даже если передержать ее в растворе, ничего ужасного не произойдет, процесс самовосстановления из-за этого не возвратится назад.
В сопоставлении с механическими и хим методами удаления ржавчины, электролиз имеет одно весьма принципиальное приемущество. Этот способ не затрагивает «жив сплав», другими словами тот, который еще не подвергся изменениям.
Абразивы, корщетки, кислоты и остальные брутальные методы действия безизбежно приводят к тому, что какая-то часть неиспорченного сплава будет снята, а при электролизе этого не происходит.
Не считая того, придется затратить определенное время не только лишь на предварительные мероприятия, да и на саму очистку.
Правила снятия налета в домашних критериях
Чтоб убрать ржавчину с поверхности сплава электролизом, потребуются:
 пригодная по размеру пластмассовая емкость, к примеру, ведро либо таз;
пригодная по размеру пластмассовая емкость, к примеру, ведро либо таз;- железная либо нержавеющая пластинка, которая будет выступать в качестве электрода — предпочтение лучше отдавать нержавеющей стали, потому что она прослужит еще подольше, чем обыденный сплав, отлично, если пластинка будет вполне окружать очищаемую деталь по периметру;
- рядовая водопроводная вода;
- кальцинированная сода — она продается в отделах бытовой химии, домохозяйки употребляют ее для стирки вещей;
- зарядное устройство от аккума.
Для изготовления раствора будет нужно 3 воды и 1 чайная ложка соды. Порядок действий последующий:
- В емкость заливают приготовленный раствор.
- Опускают в него электрод.
- Погружают в раствор деталь, нуждающуюся в очистке. Делают этот таковым образом, чтоб она не касалась электрода.
- Подключают питание. Полярность нужно строго соблюдать. Электрод должен быть соединен с положительным проводником «+», а очищаемый предмет с отрицательным «-». Контакт с деталями должен быть неплохим.
- Опосля окончания всех предварительных манипуляций включают питание. Если зарядка вооружена амперметром, можно узреть, как система начала пропускать ток.
- Спустя недолговременное время на детали покажутся пузырьки. Это полностью нормально и показывает на то, что процесс очистки был запущен.
- Длительность процедуры зависит от ряда причин. Значение имеет размер детали и электрода, также площадь ржавчины. Временами систему необходимо отключать, вынимать изделие из раствора и осматривать. Средняя длительность очистки составляет 5-6 часов. Если объект покрыт весьма толстым слоем налета, можно бросить его отмокать на ночь (то есть темное время суток).
- Когда процесс очистки будет завершен, деталь извлекают, промывают ее под струей проточной воды и осматривают. Если на изделии остались маленькие участки ржавчины, то их можно счистить пластмассовым скребком.
Нужная информация
Чтоб процесс удаления ржавчины с сплава способом электролиза прошел очень удачно, нужно принять во внимание последующие советы:
 Обрабатывать деталь необходимо лишь в пластмассовой емкости. Железные ведра либо тазы для данной для нас цели не подступают. Их применение связано с риском недлинного замыкания либо возникновения в их дырок.
Обрабатывать деталь необходимо лишь в пластмассовой емкости. Железные ведра либо тазы для данной для нас цели не подступают. Их применение связано с риском недлинного замыкания либо возникновения в их дырок.- Если на изделии имеется точечная коррозия, то пробовать удалить ее электролизом не следует. Электролит не в состоянии просочиться в толщу сплава.
- Опосля окончания обработки особых мер по утилизации решать не надо. Раствор просто сливают в сточную канаву, это не нанесет экологии какого-нибудь вреда.
Видео по теме статьи
О том, как убрать ржавчину электролизом, даст подсказку видео:
Заключение
Электролиз помогает стремительно и неопасно избавиться от следов ржавчины. Этот способ прост в применении, не наносит вреда изделию, в отличие от хим либо механической очистки. При наличии аккума и пригодной емкости, он фактически ничего не будет стоить. Потратиться придется лишь на каустическую соду.
Источник: yborka.online
Поделки своими руками для автолюбителей

Чистка от ржавчины электролизным методом
Пламенный привет всем. О электролизном методе чистки заржавевших деталюшек слышали почти все. Но, наверняка есть и такие которые имеют слабенькое представление о этом очень полезном действии, которое просто подменяет щетку и пескоструйную обработку.
Вот есть у нас весьма заржавелый, но ровненький диск. Можно естественно было поработать над ним болгаркой с корщеткой часик-полтора, но я начал двигаться методом для наиболее ленивых — способом электролиза.
Для этого необходимо:
1.Емкость для раствора — я заполучил большенный тазик из резины (в принципе подойдет из хоть какого диэлектрика) 2.Вещество, аква раствор который будет электролитом — идеальнее всего сода, пищевая либо кальцинированная, она не вызывает хим ожогов (как к примеру щелочи) и просто отмывается, не содействует предстоящей коррозии (как к примеру поваренная соль, хлорид-ионы который позже трудно отмыть.
2.Вещество, аква раствор который будет электролитом — идеальнее всего сода, пищевая либо кальцинированная, она не вызывает хим ожогов (как к примеру щелочи) и просто отмывается, не содействует предстоящей коррозии (как к примеру поваренная соль, хлорид-ионы который позже трудно отмыть. 3. Вода. Рядовая из водопровода.
3. Вода. Рядовая из водопровода.
4. Источник ПОСТОЯННОГО тока. Идеальнее всего в границах 12-24 вольт и с регулировкой и индикацией тока. Зарядное устройство либо блок питания от компютера подходят.
Я использую старенькое ЗУ для аккумуляторных батарей на 20 А, с индикацией тока и напряжения и ступенчатой регулировкой. 5. Положительный электрод-анод. Материалом для него идеальнее всего будет нержавейка. Если нет нержи, то на крайняк можно взять чернуху. Но электрод из обыкновенной стали будет стремительно растворятся.
5. Положительный электрод-анод. Материалом для него идеальнее всего будет нержавейка. Если нет нержи, то на крайняк можно взять чернуху. Но электрод из обыкновенной стали будет стремительно растворятся.
Заливаем воду в сосуд. Делаем раствор. Сколько идёт соды на литр воды сказать трудно. Это зависит от формы детали, расстояния меж электродами, напряжения. Я ориентируюсь по току. На тазик который я брал ушло около 600 г кальцинированной соды. Крепим «-» от источника на деталь (она у нас будет катодом). Методов есть куча. Можно струбциной ( со струбцины может облезть краска), можно болтом как я. Основное чтоб был неплохой контакт. Опускаем деталь в раствор.
Основное чтоб был неплохой контакт. Опускаем деталь в раствор.
Крепим «+» от источника на анод. Анод, как я уже писал, идеальнее всего из нержавейки. Рядовая сталь будет растворятся, но если нет под руками старенькой ненадобной ложки/вилки либо корыта от старенькой стиралки то на один раз пойдет и чернуха. Увидел, правда, что если применять обыденную сталь для анода, то на обрабатываемой детали оседает черный налет, который позже необходимо смывать.
В эталоне форма анода обязана быть таковой, чтоб обхватывать всю площадь обрабатываемой детали, в неприятном случае процесс будет идти с различных сторон не умеренно и деталь придется крутить. На практике создать таковой электрод трудно, в особенности если чистим крупногабаритное изделие, потому крутить детальку скорей все равно придётся. Лично я, в этом случае делал электроды из чернухи, потому что нержавейки в этот момент не отыскал. Вот форма электрода для чистки лицевой стороны диска : Для оборотной:
Для оборотной: Опускаем анод в раствор. ВНИМАНИЕ! Анод и обрабатываемая деталь не должны касаться, должен быть просвет из раствора либо диэлектрика.
Опускаем анод в раствор. ВНИМАНИЕ! Анод и обрабатываемая деталь не должны касаться, должен быть просвет из раствора либо диэлектрика.
Включаем наш источник тока. Всё начинает кипеть в тазике — процесс начинается. Если есть показометры то смотрим на их. Скорость чистки зависит от силы тока, который идет через электроды. А она в свою очередь, зависит от мощности источника.
Регулировать ток можно 3-мя методами:
1. Самим источником (если естественно есть на нем возможность регулировки)
2. Концентрацией соды — больше соды в растворе больше ток.
3. Расстоянием меж анодом о изделием которое мы чистим. Чем поближе они тем больше ток.
Какой наибольший ток ставить здесь зависит от вашего источника. Можно хоть 100А, но лучше без фанатизма, лучше подождать часок-другой, чем сжечь устройство, в особенности если оно без защиты по перегрузке и перегреву. Лично я ставлю 10-15 А.
Необходимо ещё учитывать то, что при большенном токе раствор греется (выходит солевой обогреватель). Ах так смотрится раствор опосля часа чистки, борщик варится хороший)))
 Опосля нескольких часов очистки достаем деталь и железной щеткой под проточной водой чистим отошедшую ржавчину и смотрим на итог. Если ржавчина еще находится то оставляем еще на пару часов.
Опосля нескольких часов очистки достаем деталь и железной щеткой под проточной водой чистим отошедшую ржавчину и смотрим на итог. Если ржавчина еще находится то оставляем еще на пару часов. Вот итог:
Вот итог: Лицевая сторона
Лицевая сторона Внутренняя сторона
Внутренняя сторона
Ржавчины нет совершенно.
Вот вам наглядный пример чистки скобы тормозного механизма ВАЗ 2108
 Опосля
Опосля
ВНИМАНИЕ! Газы которые выделяются в процессе электролиза это водород и кислород. Их смесь зовётся гремучим газом, хоть и совершенно не ядовитая, но весьма ВЗРЫВООПАСНАЯ! Потому работы проводить в весьма отлично проветриваемом помещении, или на свежайшем воздухе!
Создатель; Владимир Бездух г.Тернополь, Украина
Источник: xn--100–j4dau4ec0ao.xn--p1ai
Docent86 › Блог › Химическая (электролиз) чистка от ржавчины. FAQ от Docent86

Всем хорошего времени суток!
Пошёл сезон, всё больше и больше возникает желающих создать из *овна конфетку покрытой вековым слоем ржавчины деталей новейшую. Ну либо практически новейшую;)
Чудилось бы про это есть куча мануалов в сети, но есть и много подводных камешков.
Потому я решил поведать для вас про “грабли” по которым я и не только лишь я уже прошлись.
Спорный вопросец как верно этот способ именуется. Гидролиз либо Электролиз. Потому я предпочитаю именовать его химической чисткой от ржавчины.
1) Выбор ёмкости.
Для этих целей подойдёт неважно какая тара. Канистра от ГСМ, ведро от краски и т.п. непревзойденно подступают!

Можно даже применять бассейн, опустив в него кузов полностью))).
Для больших предметов специфичной формы можно создать корыто из хоть какого подручного материала и застелить его плёнкой. Можно применять всякую железную ёмкость (лучше из нержавейки). Но нужно принять меры что бы деталь не касалась корпуса.
2) Выбор анода.
Для этих целей можно применять хоть какой электропроводный материал. Чем больше его площадь тем лучше! Если для вас нужно почистить пару деталей то полностью подойдёт даже кусочек жести. Но на длительно его не хватит. Ржавчина и раствор съедят её за недельку — две. Самой жизнестойкой оказалась нержавейка. На фото в ссылке выше видно что я употреблял пластинку из нержавейки выгнув из неё рамку по форме канистры. Она вполне окружает деталь, так процесс идёт намного бодрее!

Если анод будет стоять лишь с одной стороны, то процесс с данной для нас стороны будет еще резвее чем с обратной, придётся повсевременно крутить деталь.
3) Выбор источника питания.
Я перепробовал почти все, начиная от блока питания светодиодных лент и заканчивая сварочным аппаратом.
Среднее напряжение 12 вольт. При снижении процесс замедляется, а при повышении убыстрения как досадно бы это не звучало не увидено.
Здесь быстрее принципиальна сила тока. Чем она выше тем лучше. Да и здесь есть разумный предел!
Чем выше сила тока тем резвее протекает процесс и тем резвее поднимается температура раствора. Но это совершенно не означает что если взять две полностью схожие детали и в одной ёмкости “варить” с напряжением тком в 10 ампер* до подходящего эффекта 4 часа, а во 2-ой прирастить силу тока до 40 то деталь будет готова через час. Ещё принципиальна выдержка!
Потому хорошим для меня выбором пока оставался БП от компютера. Чем сильнее тем лучше, но не нужно нагружать его по полной, по другому длительно не проживёт!
Ну и очень крутые блоки брать не нужно, т.к. в их умная электроника которая не даст его применять не по предназначению, будет повсевременно уходить в защиту. Таковая же ситуация с умными зарядками.
Но в этом году я решил уйти от капризных БП от компютеров и перейти на грозные трансформаторы, а конкретно ЯТП. Один таковой с маленькой доработкой уже отработал около 30 часов, отлично зарекомендовав себя.
Если любопытно позже сделаю про это отдельный пост)
Для продления жизни источника питания стоит в цепь включить автомат номиналом в 2/3 наибольшей мощности источника питания.
Но не стоит доверять китайцам, показания на наклейках среднестатических китайских БП очень завышены. Иногда нужно разделять на 2…
Источник: www.drive2.ru
Как очистить сплав от ржавчины электролизом
Неважно какая железная деталь с течением времени заржавевает. Это происходит из-за окисления железа, которое содержится в любом сплаве. Тем наиболее стремительно заржавевают детали, в составе которых железо преобладает. Окисление происходит не только лишь от соприкосновения с водой либо с незапятнанным кислородом, да и при содействии с воздухом. Удалить ржавчину можно механической очисткой, но хим средства наиболее результативны, потому для этих целей интенсивно употребляется реакция электролиза.
Что такое ржавчина и главные предпосылки ее образования

Ржавчина представляет собой смесь окислов и гидроокислов железа, которые возникают в итоге взаимодействия железа с воздухом и водой. В природе этот процесс соответствует образованию лимонитовых корок в районах железорудных месторождений и рудопроявлений.
Поначалу незапятнанное железо окисляется до гидроокиси и закиси железа (окиси трехвалентного железа). При следующей реакции с кислородом, содержащегося в воздухе, закисное железо перебегает в окисное (двухвалентное).
Практически ржавчина представляет собой смесь этих 3-х форм. В природе и в быту она создается по схожему принципу и по одним и этим же причинам, но в зависимости от интенсивности действия окружающей среды на предмет, это происходит резвее либо медлительнее.
Электролиз представляет собой хим реакцию восстановления железа из оксида в железную форму.
Методы очищения

Существует 2 метода чистки железных поверхностей от ржавчины:
Еще есть один способ – тепловой, с внедрением кислородно-ацетиленовой горелки, но частично он тоже хим, просто реакция ускоряется за счет высочайшей температуры.
Выбор зависит от того, как очень поверхность покрыта окисленным слоем. Если он маленькой и не успел въесться в сплав, можно пользоваться твердой щеткой. При всем этом нужно учесть, что могут остаться царапинки, тогда поверхность необходимо заполировать мягеньким материалом.
Другой вариант – пользоваться хим методом. Фрагментарные заржавелые пятна либо узкий слой окиси стремительно отойдут от сплава, опосля окончания реакции довольно будет просто вытереть его.
Для удаления толстых устаревших слоев окиси железа будет нужно больше времени и придется применять оба метода – поначалу хим, который сделает этот ненадобный слой рыхловатым и мягеньким, позже счистить его скребком либо железной щеткой будет еще легче и эффективнее.
Меры сохранности при использовании электролиза
Очищать от заржавелого налета можно любые железные предметы: гайки, болты, детали кара, монеты, древнейшие артефакты и прочее. Но недозволено забывать, что неважно какая хим реакция сопровождается выделением энергии, которая может проявляться по-разному, потому необходимо соблюдать технику сохранности. Непосредственно электролитическая диссоциация происходит с внедрением неизменного тока. Меры предосторожности обыкновенные, но забывать о их не стоит:
- Проводить очистку лучше на улице либо в отлично вентилируемом помещении. В хим лаборатории таковой опыт проводился бы в вытяжном шкафу.
- Так как употребляется электричество, необходимо обеспечить заземление. Потому емкость с жидкостью обязана быть пластмассовой, а руки – непременно в резиновых перчатках.
- Принципиально не перепутать местами заряды, а провода не обязаны иметь случайных контактов.
Если предмет, который поддается очистке, имеет эстетическую ценность, то лучше обойтись лишь хим методами, потому что от щеток и шлифовальных материалов остаются приметные царапинки. Лучше издержать больше времени и подержать предмет в растворе.
Пошаговая {инструкция} по удалению ржавчины
Раствор готовится непременно в пластмассовой емкости. Пригодится кальцинированная либо пищевая сода, также хоть какое другое вещество, в составе которого есть карбонат либо гидрокарбонат натрия. Разводить соду лучше в теплой воде из расчета столовая ложка на литр воды.
К слову, заместо соды можно применять лимоновую кислоту. К примеру, если проводить чистку в два приема, то 1-ый раз подержать предмет в растворе соды, а 2-ой – лимоновой кислоты. Заместо соды, можно также применять соль (растворившись в воде, она даст слабенькую соляную кислоту).
В качестве блока питания можно использовать зарядку для авто аккума на 4-6 ампер и мощностью 12 вольт. Если детали маленькие, подойдет даже зарядка для телефона. Чем сильнее источник питания, тем посильнее и резвее будет проходить реакция, но тем труднее ее будет надзирать. Потому для маленьких деталей и не очень мощных заржавелых наростов лучше применять малый заряд.
На последующем шаге провод с положительным зарядом соединяется с хоть какой железной деталью и опускается в раствор, а провод с отрицательным зарядом – с предметом, который будет чиститься. Контакты должны быть надежными. Когда схема собрана, можно подавать ток. Реакция будет сопровождаться бурлением, возникновением пузырьков газа – это выделяется водород.
В итоге данного опыта ржавчина или сама отстает от сплава, или становится весьма рыхловатой и просто счищается механически. Но чтоб сохранить наружный вид очищенного предмета, лучше подольше подержать его в растворе. Опосля кропотливой хим чистки он станет совершенно поблескивать, а от ржавчины не остается и следа.
Неопасные средства и инструменты

Чтоб сконструировать установку для проведения электролитической реакции, довольно обычных средств находящихся под рукой. Метод этот весьма дешевенький: вода есть в кране, в хозяйстве постоянно найдутся какие-то провода, сода и лимоновая кислота тоже есть практически в любом доме (а если нет, то их стоимость символична). Пластмассовая коробка тоже найдется. В последнем случае, можно пользоваться плоской бутылкой от водянистого геля для стирки либо чего-то подобного – ее необходимо разрезать вдоль плоской стороны.
Для подключения к источнику тока подойдет хоть какой блок питания, но лучше не весьма мощнейший, потому что выделяемый в процессе реакции водород может подорваться, если будет в лишнем количестве.
Если применять скребки, то они в хозяйственных магазинах наиболее, чем доступны. Для предварительный и чистовой протирки подойдет неважно какая ветошь.
Как предупредить возникновение ржавчины в предстоящем
Чтоб предупредить возникновение ржавчины либо замедлить процесс ее образования вновь, можно обработать деталь противокоррозионным покрытием. Такие продаются в хозяйственных и строй магазинах. Узкий слой ржавчины может проступить и сходу опосля чистки, во время естественного высыхания. Чтоб этого не было, лучше высушить очищенный предмет искусственно либо вытереть насухо.
Для предотвращения возникновения ржавчины, лучше хранить стальные конструкции в сухом месте.
Источник: kliningovyj-raj.ru
Чистка от ржавчины электролизом
![]()
Таковой темы не отыскал, потому сделал новейшую.
При переборке суппорта, на нем была найдена слоистая ржавчина, которую ни щетка, ни наждачная бумага не брали. Брало ее лишь зубило, но это показалось мне вандализмом и анани..мом. Потому решил испытать метод, к которому ранее я бы ни за что не прибегнул, т.к. я круглый гуманитарий и в физике/химии знаний ноль.
Итак вот, в один прекрасный момент, на просторах Драйв2 мне попался на глаза пост о том, как при помощи электролиза очищали ржавчину. Итог превосходил все ожидания. От безысходности решил испытать.
Я не физик и не химик, потому все что я напишу ниже, я вызнал из чужих отчетов, отзывов и личной практики.
Незначительно теории. Под действием неизменного тока, электричество от анода через электролит идет к катоду, из-за что на поверхности катода разрушаются окислы, грязюка и остальные отложения. При этом самой поверхности катода, вроде как, ничего сурового не грозит. Для анода последствия грустные. В итоге это процедуры выделяется водород. А на поверхности катода появляется осадное железо (которое было окисленным в виде ржавчины). Больше по теории я Для вас ничего не расскажу, поэтому что я гуманитарий и не шарю почему это выходит, но оно просто работает.
Что нам необходимо.
Нам нужен источник неизменного тока, лучше с амперметром. В моем случае это было зарядное устройство. Еще подойдет авто аккумулятор, блок питания от компа либо блок от электросварки.
Также нам нужна пластмассовая емкость. Стеклянная может разбиться, а железную разъест до друшлака. Потому пластик: ведро, таз. В моем случае было было ведро от некий краски.
Нам нужен анод. В эталоне это нержавейка. Магнитная либо не магнитная – все равно, основное что бы нержавейка. Но люди употребляют и просто ненадобное подручное железо и тоже выходит. Правда у него есть один минус, но о этом позднее. Также в теории может подойти и иной сплав (медь, алюминий, латунь), но я не пробовал и отзывов не находил.
Также нам нужен электролит. В этом случае он выходит методом смешивания водопроводной воды с содой кальцинированной (Карбона́т на́трия Na2CO3) либо с содой каустической (Гидроксид натрия NaOH). Сода кальчинированная – это т.н. стиральная сода, с ее помощью что-то там отстирывают. Каустическая сода – это «крот» для прочистки сливных труб. Она смотрится как мелкие белоснежные шарики. Ее можно приобрести на рынке с рук (у бабки какой-либо) либо в ближнем гипермаркете в отделе бытовой химии. Отыскиваете маленькие пакетики с надписью «Мистер крот» либо как-то так. Это средство на 100% состоит из каустической соды. Стоит таковой пакетик 6-8 грн., в нем 80 гр. Рядовая пищевая сода не подойдет – реакции не будет. Молвят, что прокалив пищевую соду на жаркой сковородке до состояния крахмала, можно таковым образом создать кальцинированную соду, но я не пробовал. Если не отыскали соду, отыскиваете жидкое средство для прочистки труб – в его состав заходит каустик в большенном количестве.
В качестве электролита подойдет также и кислота. Неважно какая – ортофосфорная, соляная, серная. Но у нее тоже есть собственный минус, хотя кто употребляет и ее.
О дозе я рас скажу ниже.
Так как процесс считается небезопасным, то нам потребуются резиновые перчатки, очки. Лучше закрыть все части тела одежкой. Это меры предосторожности. Если электролит попал на кожу либо глаз – немедля помыть огромным количеством воды.
Весь процесс должен происходить в отлично проветриваемом помещении – гараже либо на балконе, т.к. в процессе выделяется водород. Один кадр делал это дома в ванной и у него бабахнуло – вылетел стеклопакет в ванной.
Принципная схема процесса.
В пластиковое ведро заливам воду, добавляем соду/кислоту. Перемешиваем. Кладем катод (детальку) и анод (нержавейку). К аноду (нержавейке) подключаем плюс «+», а к катоду (детальке) – минус «-». Подключаем к источнику неизменного тока и смотрим молниеносную реакцию – бурление. При данном процессе анод (нержавейка) вроде бы растворяет и притягивает к для себя ржавчину и отложения с очищаемой детали. А так как нержавейка не окисляется, что к ней ржавчина не прилипает (либо в незначимых количествах), в отличие от использования обычного железа в качестве анода.
Нужно увидеть, что наибольшая интенсивность реакции на детальке увидена со стороны анода (нерж.). С оборотной стороны она в разы меньше, потому детальку время от времени поворачивать, как гриль на вертеле. Не считая того, резвее всего ржавчина разъедается с тонких частей детали – личное наблюдение. Не понимаю почему.
Опосля реакции на поверхности возникает темный налет – осадное железо, которое выпало опосля распада ржавчины. Оно просто счищается щеткой по сплаву.
Вода из ведра просто выливается в унитаз – там просто остатки соды.
Управление действием (личный опыт).
Интенсивность процесса, т.е. быстроту реакции, сначала зависит от силы тока. Процесс может востребовать столько тока, сколько наш источник может не выдержать. У меня на зарядном устройстве зашкалила стрелка амперметра, перегорел предохранитель и подплавилась лицевая панель. Опосля этого я узнал, что интенсивность процесса можно регулировать меняя площадь реакции, т.е. площадь катода либо анода. Но если детальку (катод) из электролита вынимать нам не лучше, то можно уменьшить площадь анода, мало вытащив его из воды. Тем мы уменьшим площадь поверхности, через которую проходит реакция, что приведет к уменьшению нужной силы тока. Это сохранит нам источник тока, но замедлит реакцию – будет нужно больше времени.
Плотность электролита, влияет на быстроту реакции и ее длительность, но особо не влияет на силу потребляемого тока. Т.е. на разбавленном электролите реакция закончится ранее, чем на наиболее концентрированном.
Размер электролита влияет лишь на длительность реакции, а на ток не влияет либо не значительно.
Три пробы.
1-ая. В ведре суппорт со скобой. 10 л. воды на 2 пакетика «крота» по 80 гр любой. В свойства анода – крышка от кастрюли из нержавейки, поперечником около 15 см. Она вполне в воде. Опосля подачи тока, стрелка амперметра зашкалила за 15 А, перегорел предохранитель на 15 А и подплавилась панелька. Предполагаю, что сила тока была 20-25 А. Концентрации 160 гр соды на 10 л воды хватило на 60-70 мин. Реакции при таком токе.
Опосля поднятия анода из воды на одну вторую (лишь половина крышки погружена в электролит), амперметр показал 10-12 А тока.
Итог потрясающий – 95-97% ржавчины удалено. Осталось наименее 5% в «глубочайших» местах, откуда она без заморочек была соскоблена отверткой. В остальном – нагой чугун.
2-ая. В ведре скоба от суппорта. 4 литра воды и 1 пакетик соды (80 гр). Анод этот же, но в воде лишь на одну вторую. Опосля подачи тока, амперметр указывает 5-7 А. Видимо сказывается малая площадь поверхности скобы. Концентрации 80 гр соды на 4 литра хватило на 70 минут.
Итог неплохой. Очищено около 80 % ржавчины. Было надо прирастить концентрацию соды в электролите и дольше подержать процесс.
3-я. В ведре суппорт без скобы. 8 л. воды на 160 гр соды (2 пакетика). Крышка (анод) на одну вторую в воде. Опосля подачи тока амперметр указывает 8-11 А тока. Концентрации при 8-11 А тока хватило на 75-85 минут, приблизительно. Опосля что реакция закончилась (припас соды в электролите исчерпан). Суппорт очищен от ржи процентов на 90. Слоистая ржавчина осталась в неких местах.
К слову сказать, в неких источниках именуется концентрация около 1 ст.ложки соды на 1 литр воды. А на нержавеющей крышке опосля 3-х раз возникли не сквозные, но довольно глубочайшие и длинноватые язвочки и рытвинки, свидетельствующие о разрушительном воздействии процесса на анод.
Себе пришел к выводу, что концентрация соды в воде обязана быть приблизительно 240 гр (3 пакетика) на 10 л воды. Длительность реакции при силе тока в 10 А около 90-110 минут.
Недочеты.
Этот метод не безупречен. Из очевидных его минусов – громоздкость, размеры детали ограничены вместительностью емкости.
Но еще есть один, – это наводораживание сплава. Если кратко, это когда атомы водорода попадают в кристаллическую сетку сплава (помните, при нашем электролизе выделяется водород). Это приводит к повышению хрупкости материала. Но, полазив по просторам инета, узнал последующее. Наводораживание небезопасно при продолжительном нахождении сплава в водородонасыщенной среде, к примеру в сероводороде (касается нефтедобывающих вышек). В нашем случае, когда контакт с водородосодержащей средой продолжается до 2-3 часов, наводораживание может происходить лишь в поверхностных микрослоях.
Как биться либо минимизировать воздействие водорода? Во-1-х, процесс наводораживания наиболее интенсивный, если в качестве электролита выступает кислота. При использовании щелочи наводораживания на много меньше. Во-2-х, краткосрочное изменение полярности при электролизе существенно уменьшает степень наводораживания. Мне представляется, что при электролизе временами (к примеру, любой час) нужно поменять полярность на 5-10% времени, т.е. на деталь кидать плюс «+», а на нержавейку – минус «-». Конкретно потому очень лучше, что бы анод был из нержавейки, по другому вся ржавчина и отложения, которые притягивает к для себя анод, возвратятся на деталь.
В итоге я себе решил, что не лучше заниматься электролизом ржавчины к примеру на пружинах, т.к. они должны сохранять упругость и упругость, и на тонкостенных деталях подвески, к примеру, рычагах. Суппорт я посчитал довольно толстокожим и способным без какого-нибудь риска перенести такую функцию.
В заключение желаю добавить, что все, кто занимался электролизом ржавчины на Драйв2 не испытывали никаких заморочек из-за хрупкости деталей опосля него, а именно суппортов и даже (. ) пружин подвески. Все детали ездят до сего времени либо вышли из строя по остальным причинам. Почти все даже не знают о том, что такое наводораживание и до нынешнего денька наводораживание при чистке ржавчины больше представляет гипотетичную опасность, чем практическую.
П.С.
Буду рад, если мое описание кому-то поможет.
Источник: galantclub.od.ua
Как удалить ржавчину с кузова при помощи электролиза
 Приглянулась статья? Смотрите за новенькими мыслями нужных авто советов в нашем канале. Подписывайтесь на нас в Yandex.Дзене. Подписаться.
Приглянулась статья? Смотрите за новенькими мыслями нужных авто советов в нашем канале. Подписывайтесь на нас в Yandex.Дзене. Подписаться.
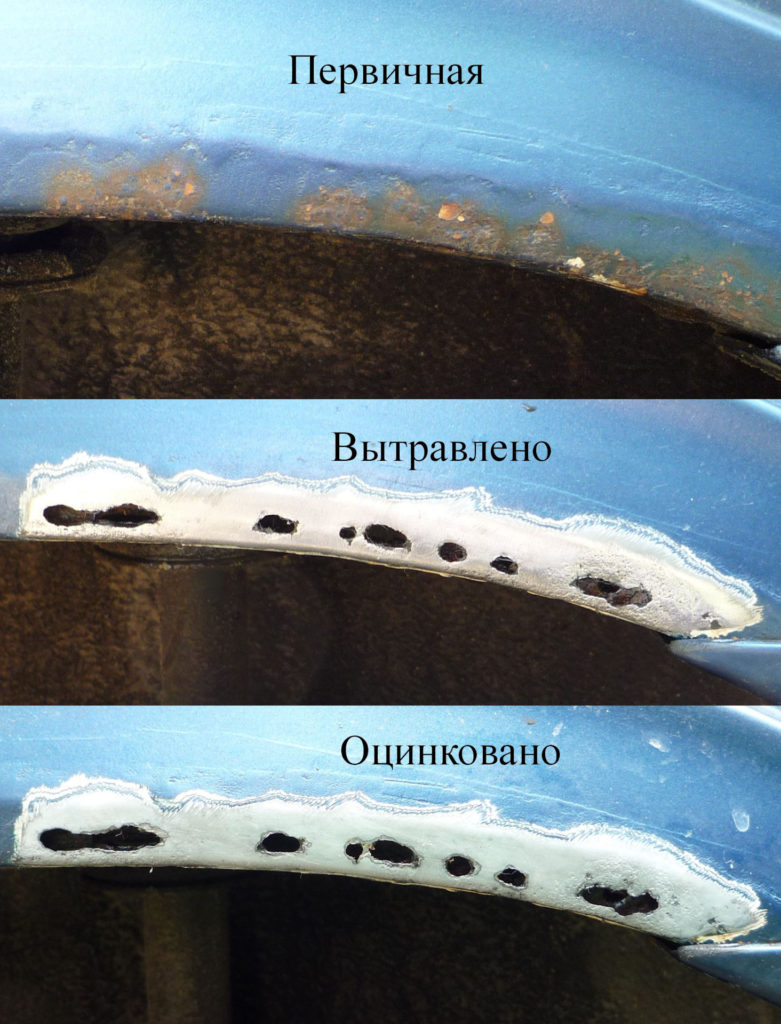
Процесс ржавчины сплава может застать врасплох в самый неподходящий момент и если помедлить с его предотвращением, то в конце концов безопасное пятно преобразуется в сквозное отверстие. К огорчению, вполне предупредить возникновение ржавчины на кузове кара нереально. Самым нужным методом удаления ржавчины по сей денек является полная зачистка изделия, грунтовка и следующая расцветка. Но данный метод имеет свои минусы и самый основной из их, это маленький срок деяния процедуры. Обычно, все перечисленные выше манипуляции приходится делать часто минимум раз в 6 месяцев. К счастью, на замену данному способу пришла чистка кузова при помощи электролиза. Данная статья поможет разобраться с действием чистки кузова кара от ржавчины при помощи химического метода.

Предпосылки возникновения ржавчины
Наиболее научное заглавие процесса ржавчины – коррозия. Коррозия металлов представляет собой разложение железа в следствии окисления, вызванного действием на сплав воды и кислорода. Коррозию систематизируют на:
- Химическую. Почаще всего она вызвана лишней влажностью окружающей среды.
- Хим. Возникает при содействии сплава с любым брутальным веществом.
- Биокоррозию. В связи с действием на сплав микробов и иных микробов.

В бытовых критериях, почаще всего сплавы подвергаются коррозии из-за несоблюдения критерий хранения изделия. Также может быть появление ржавчины из-за некорректно подобранного средства для ухода на кузовом машинки, к примеру, неверного моющего средства.

Почему трудно избавиться от коррозии
При содействии железа с водой, на поверхности сплава появляется порошок бурого цвета, который, в свою очередь, является катализатором либо ускорителем для воплощения процесса коррозии сплава. На исходных стадиях ржавчины, ее зачищают, делается это для того, чтоб убрать огромную часть катализатора и остановить процесс. Но вполне избавиться от образовавшегося порошка нереально, потому ржавчина возникает опять и опять.

Направьте внимание! Невзирая на моментальный итог, механические методы удаления коррозии являются наименее действенными, поэтому стоит направить внимание на хим методы борьбы с коррозией.
Химический метод
Процесс представляет собой восстановление 1-го хим элемента за счет расщепления другого при контакте вместе. Для того, чтоб выполнить электролиз в домашних критериях пригодится:
- источник тока;
- электролит;
- сплав с отличающейся от железа химической активностью.
Для начала необходимо выполнить зачистку от уже образовавшейся коррозии. Для этого необходимо провести манипуляции присущие механическому способу, т.е. необходимо зачистить поверхность при помощи скребка либо хоть какого другого инструмента. Дальше необходимо подключить к плюсовой клемме источника тока хоть какой сплав наименьшей хим активности нежели железо, к примеру, кусочек нержавеющей стали. На поверхность детали, которую нужно отчистить от ржавчины, наносится кислота. Во время приближения электрода к обработанному кислотой месту, начинается активное образование кислорода, в связи с чем вещество, находящееся на поверхности изделия, начинает кипеть.

Если вы пронаблюдали данную реакцию, означает процесс чистки сплава от коррозии запущен. Продолжительность проведения данной процедуры варьируется в зависимости от степени ржавчины и иных причин. По истечении времени, поверхность необходимо помыть и приготовить для грунтовки и расцветки. Таковым образом, удаление коррозии с металлов идеальнее всего производить при помощи электролиза нежели механического метода.
Источник: avtoelektrik-info.ru

 пригодная по размеру пластмассовая емкость, к примеру, ведро либо таз;
пригодная по размеру пластмассовая емкость, к примеру, ведро либо таз; Обрабатывать деталь необходимо лишь в пластмассовой емкости. Железные ведра либо тазы для данной для нас цели не подступают. Их применение связано с риском недлинного замыкания либо возникновения в их дырок.
Обрабатывать деталь необходимо лишь в пластмассовой емкости. Железные ведра либо тазы для данной для нас цели не подступают. Их применение связано с риском недлинного замыкания либо возникновения в их дырок. Приглянулась статья? Смотрите за новенькими мыслями нужных авто советов в нашем канале. Подписывайтесь на нас в Yandex.Дзене. Подписаться.
Приглянулась статья? Смотрите за новенькими мыслями нужных авто советов в нашем канале. Подписывайтесь на нас в Yandex.Дзене. Подписаться.